УДК 618.145
Анализ динамики ультразвуковых данных на фоне терапии гиперплазии эндометрия кок с биоидентиным эстрогеном и микронизированным прогестероном
ИЛИ
СРАВНИТЕЛЬНАЯ ЭФФЕКТИВНОСТЬ ТЕРАПИИ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ КОК С БИОИДЕНТИНЫМ ЭСТРОГЕНОМ И МИКРОНИЗИРОВАННЫМ ПРОГЕСТЕРОНОМ ПО ДАННЫМ ДИНАММИЧЕСКОГО УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ
Тен А.Р., Обоскалова Т.А., Вишнева Е.М.
Тен Анжелика Рагиповна, ассистент кафедры акушерства и гинекологии ФГБОУ ВО УГМУ. 620036, г.Екатеринбург, ул.Карасьевская, 42-25. Тел.: +79122030241, tenar79@mail.ru
Обоскалова Татьяна Анатольевна, доктор медицинских наук, профессор, заведующая кафедрой акушерства и гинекологии ФГБОУ ВО УГМУ. 620036 г.Екатеринбург, ул Краснолесье,Тел.:+79122837631, oboskalova.tat@yandex.ru
Вишнева Елена Михайловна, доктор медицинских наук, доцент кафедры ФТЭАИ ФГБОУ ВО УГМУ, главный врач ООО «Семейная Клиника»
ФГБОУ ВО «Уральский Государственный Медицинский Университет»
Медицинский центр ООО «Семейная Клиника»
Россия, г.Екатеринбург
Резюме: Гиперплазия эндометрия (ГПЭ) в современной гинекологии рассматривается как фоновый предраковый процесс тела матки. Тенденции к подходам ранней диагностики ГПЭ направлены на поиск и применение малоинвазивных методов. Наиболее доступным методом диагностики патологии эндометрия является трансвагинальное ультразвуковое исследование органов малого таза (ТВУЗИ), позволяющее выявить наличие ГПЭ с достоверностью 86-90%. Цель исследования – определить специфичность и сопоставимость метода ТВУЗИ с гистологической картиной эндометрия.Ключевые слова: аномальное маточное кровотечение, гиперплазия эндометрия, ультразвуковое исследование органов малого таза.
Abstract: Endometrial hyperplasia in modern gynecology is considered as the background precancerous process of the uterus. Trends in the approaches of early diagnosis of endometrial hyperplasia are aimed at finding and applying minimally invasive methods. The most accessible method for diagnosing endometrial pathology is transvaginal ultrasound examination of the pelvic organs, which makes it possible to detect the presence of endometrial hyperplasia with 86–90% accuracy. The purpose of the study is to determine the specificity and comparability of the transvaginal ultrasound examination of the pelvic organs with the histological picture of the endometrium.
Keywords: abnormal uterine bleeding, endometrial hyperplasia, ultrasound of the pelvic organs
Широкий интерес к проблеме патологии эндометрия связан в первую очередь с высоким риском малигнизации гиперплазии эндометрия, который достигает 15-50% по данным различных авторов [1, 3, 5, 6]. В структуре гинекологической патологии на долю гиперплазии эндометрия (ГПЭ) приходится 40% среди всех заболеваний тела матки. [1] Чаще всего гиперплазия эндометрия диагностируется у женщин позднего репродуктивного возраста - 50%, а к перименопаузальному возрасту достигает 70%. [4, 6, 7, 9]. В последние годы отмечается прогрессивный рост ГПЭ, особенно среди пациенток репродуктивного возраста. За последние 5 лет наблюдается значительный прирост впервые зарегистрированных случаев гиперплазии эндометрия как на территории всей России, так в 2011 году на 100 тыс. женщин репродуктивного возраста этот показатель составлял 2174.4, а в 2015 году – 2387.2, так и в г. Екатеринбурге – согласно основной отчетной форме N12 по учету первичной заболеваемости в 2011 году было зарегистрировано 6094 случая ГПЭ, а в 2015 году – 7782 случая, то есть, на 27,7% больше. В среднем по г. Екатеринбургу число пациенток, подвергшихся лечебно-диагностическому выскабливанию, составляет более 3 тысяч в год [3].
ГПЭ определяется как гетерогенная группа пролиферативных процессов слизистой оболочки матки, и является исключительно гистологическим диагнозом, для постановки которого применяют «золотой стандарт»: гистероскопия с раздельным лечебно-диагностическим выскабливанием, с последующим гистологическим исследованием полученного биоптата. Данный метод диагностики позволяет не только оказать лечебный эффект в остановке кровотечения, но и провести дифференциальную диагностику с другими органическими изменениями полости матки, приводящими к маточному кровотечению. Однако, зачастую выскабливание полости матки может способствовать повреждению базального слоя эндометрия и в дальнейшем провоцирующее формирование более тяжелых форм ГПЭ или развитие нарушений репродуктивной функции [6, 7, 9].
Однако, ГПЭ может достаточно долго и не сопровождаться клиническими проявлениями. В связи с этим возникает необходимость в современном малоинвазивном и доступном методе диагностики субклинических форм ГПЭ. В данный момент наиболее доступным и неинвазивным методом диагностики патологии эндометрия является ультразвуковая диагностика. Трансвагинальное исследование позволяет выявить наличие ГПЭ с достоверностью 86-90% [7, 8], что особенно важно у пациенток с ожирением и метаболическим синдромом, которые значительно затрудняют визуализацию органов малого таза [9].
В исследовании приняли участие 70 женщин с гиперплазией эндометрия (ГПЭ), которые получали лечение в 2017 – 2018 годах, в медицинском центре ООО «Семейная Клиника». Средний возраст пациенток составил 30,3 ± 4,9 лет. Возраст наступления менархе 13,03 ± 1,44 лет (Ме = 13; Мо = 13). У 5 пациенток (1,5%) с ГПЭ наступление менархе отмечено в 15 лет и старше. Количество менструальных дней, на момент дебюта гиперплазии эндометрия, колебалось в пределах 4,9 ± 1,2 дней (Ме = 5; Мо = 4), продолжительность менструального цикла составляла 28,3 ± 3,08 дня (Ме = 28; Мо = 28). При анализе значений паритета беременность – роды – аборты были получены среднее количество беременностей 1,14 ± 1,1; количество родов – 0,73 ± 0,83; количество абортов – 0,42 ± 0,66.
Пациентки рандомизация на 2 группы проводилась с применением программы – генератора случайных чисел «Rand Stuff». 1 группа – 35 женщин, которым назначался комбинированный оральный контрацептив с натуральным эстрогеном на 6 месяцев, прием препарата пациентки начинали с 1 дня менструального цикла.
2 группа – 35 женщин, которым назначался препарат микронизированного прогестерона, вагинальная форма, в дозировке 400 мг в сутки, с 16 по 25 день менструального цикла, на 6 месяцев. Пациентки данной группы применяли барьерную контрацепцию в период гормонального лечения.
Трансвагинальное ультразвуковое исследование (ТВУЗИ) органов малого таза проводилось на 5-7 день менструального цикла через 3 и 6 месяцев терапии. ТВУЗИ органов малого таза проводили при помощи приборов, работающих в реальном масштабе времени по принципу «серой шкалы». Работа выполнялась на аппарате «SSD-2000 Multi View» фирмы «Aloka» (Япония), с использованием трансабдоминального и трансвагинального конвексных датчиков частотой 3,5 и 7 МГц. С помощью ТВУЗИ определяли: положение и размеры (длину, толщину, ширину) матки, контуры, внутренную структуру; срединное маточное эхо (М - эхо) для выявления патологии эндометрия.
Через 3 и 6 месяцев гормональной терапии показатели ТВУЗИ органов малого таза значительно изменились. Показатель М-эхо до лечения составлял 9,4±4,3 мм, через 3 месяца гормональной терапии на фоне КОК и микронизированного прогестерона отмечено достоверное снижение в 1,7 раза – 5,4±1,6 мм (t-Student=7,4313; р<0,01). Еще через 3 месяца терапии, отмечено снижение данного показателя в 1,05 раза – до 5,1±0,8 . В свою очередь, показатель RI закономерно увеличивался с 0,55±0,09, и статистически значимого увеличения достиг через 6 месяцев гормональной терапии 0,76±0,08 (t-Student=5,06163; р<0,01) (рисунок 1, 2).
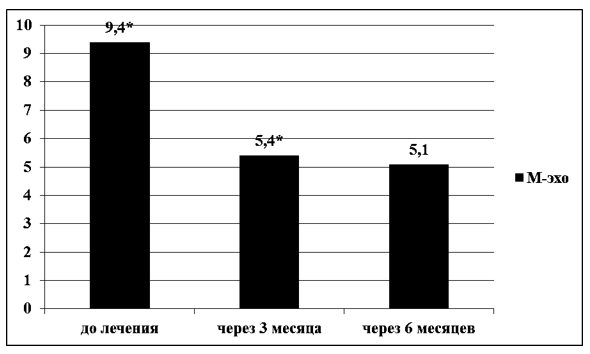
Рисунок 1 – Динамика показателя М-эхо у женщин с ГПЭ до лечения, через 3 и 6 месяцев гормональной терапии КОК с биоидентичным эстрогеном и микронизированным прогестероном, средние значения, мм, N=70, р*<0,01.
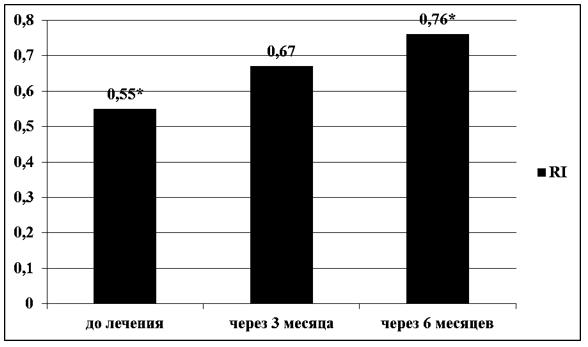
Рисунок 2 – Динамика показателя RI у женщин с АМК до лечения, через 3 и 6 месяцев гормональной терапии КОК с биоидентичным эстрогеном и микронизированным прогестероном, средние значения, N=70, р*<0,01.
Корреляционная зависимость показателей М-эхо и RI представлена на рисунках 3, 4, 5. При статистически достоверных изменениях показателей (t-Student=7,4313; р<0,01; t-Student=5,06163; р<0,01), до лечения выявлена отрицательная корреляция (индекс Пирсона -0,04486165), которая указывает, что увеличение толщины эндометрия сопровождается уменьшением показателя RI. данное явление может быть связано с усиленным развитием сосудистой сети в гиперплазированном эндометрии и, следовательно, свидетельствует о высокой пролиферативной активности и увеличении неопластического риска (рисунок 3).
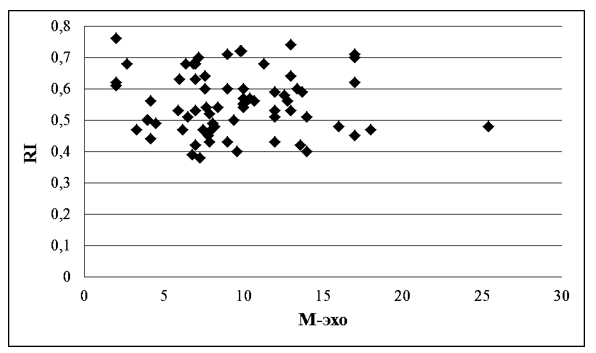
Рисунок 3 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ до начала терапии КОК с биоидентичным эстрогеном и микронизированным прогестероном, мм, N=70, индекс Пирсона= - 0,04486165.
На фоне гормональной терапии, через 3 месяца на фоне уменьшения М-эха, свидетельствующего об уменьшении гиперплазии эндометрия, повышался RI, на что указывает увеличение отрицательной корреляции между этими показателями в 4,1 раза (индекс Пирсона -0,18372654) (рисунок 4).
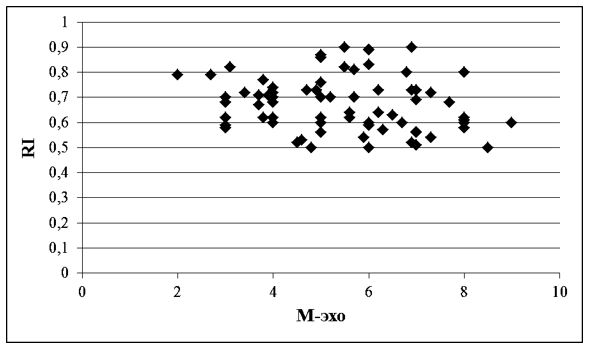
Рисунок 4 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 3 месяца терапии КОК с биоидентичным эстрогеном и микронизированным прогестероном мм, N=70, индекс Пирсона= - 0,18372654
Через 6 месяцев гормональной терапии отмечалась положительная динамика в отношении показателя RI, что свидетельствует о дальнейшем снижении неопластического риска, при нормальных показателях М-эхо. При этом теснота корреляционной связи между показателями сохраняется на высоком уровне (рисунок 5).
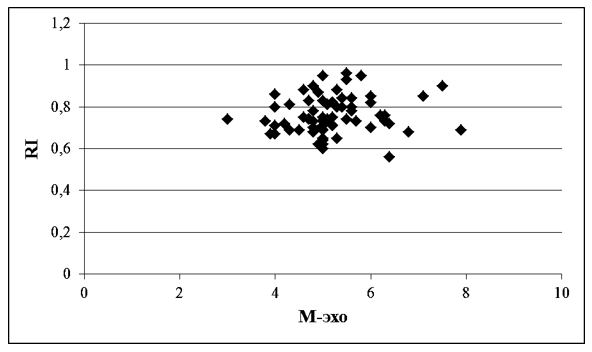
Рисунок 5 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 6 месяцев терапии КОК с биоидентичным эстрогеном и микронизированным прогестероном, мм, N=70, индекс Пирсона= 0,112498.
Аналогичная динамика изменений УЗ-показателей прослеживается в исследуемых группах (рисунки 6, 7, 8, 9). В 1-группе через 3 месяца после лечения КОК с биоидентичным эстрогеном, показатель М-эхо снизился в 2,2 раз, с 9,9±3,9 до 4,2±1,0 (t-Student=1,82771; р>0,05). Еще через 3 месяца терапии наблюдалось незначительное повышение толщины эндометрия в 1,2 раза – до 4,9±0,6 (рисунки 6,7). В целом, показатель М-эхо через 6 месяцев гормональной терапии КОК с биоидентичным эстрогеном достоверно снижался (t-Student=8,38409; р<0,01).
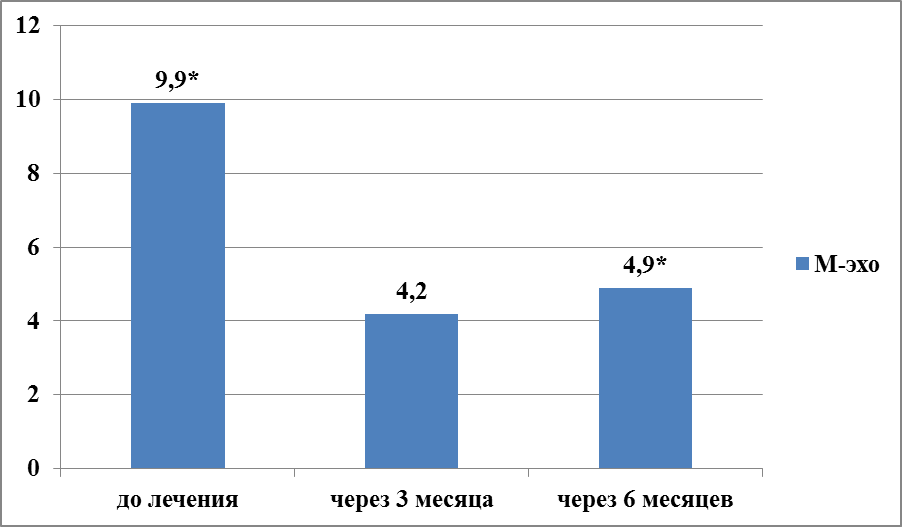
Рисунок 6 – Динамика показателя М-эхо у женщин с ГПЭ через 3 и 6 месяцев терапии КОК с биоидентичным эстрогеном (1-группа, N=35), мм, р*<0,01.
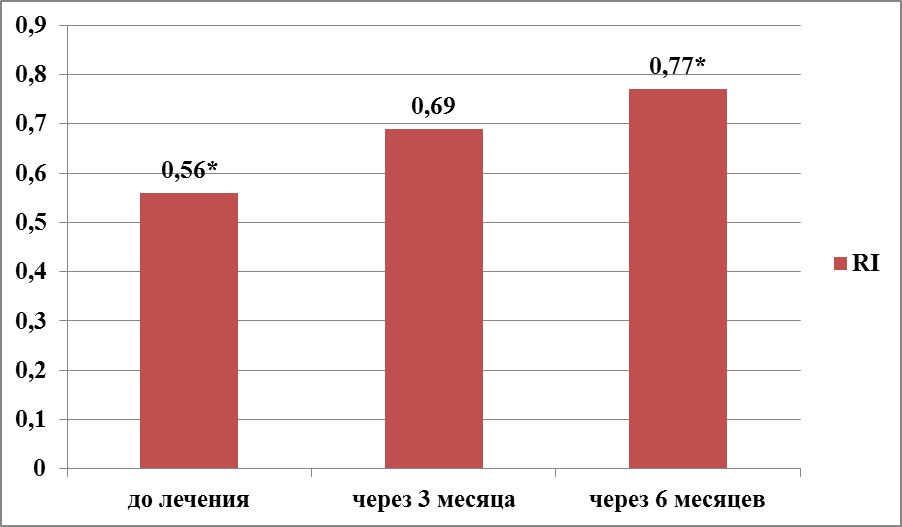
Рисунок 7 – Динамика показателя RI у женщин с ГПЭ через 3 и 6 месяцев терапии КОК с биоидентичным эстрогеном (1-группа, N=35), р*<0,01.
На протяжении всего периода лечения пациенток 1-группы отмечалась стойкая тенденция увеличения показателя RI. Достоверно значимое повышение отмечено через 3 месяца терапии на 1,2 раза – с 0,56±0,09 до 0,69±0,09 (t-Student=4,55959; р<0,01). Через 6 месяцев терапии КОК с биоидентичным эстрогеном, показатель М-эхо составил 0,77±0,06 (t-Student=1,47516; р=0,15).
В 2-группе пациенток, получавших терапию микронизированным прогестероном, отмечено более равномерное изменение УЗ-показателей (рисунки 8,9). Так, значение М-эхо после 3 месяцев лечения снизилось в 1,3 раза – с 8,9±4,7 до 6,7±1,05 (t-Student= 0,003244524; р>0,3), а после 6 месяцев терапии показатель составил 5,4±0,9 (t-Student=1,16979; р>0,25). Показатель RI закономерно и равномерно увеличивался после каждого этапа лечения микронизированным прогестероном. Через 3 месяца терапии RI увеличился в 1,2 раза – с 0,53±0,09 до 0,65±0,12 (t-Student=1,81597 ; р>0,05), через 6 месяцев терапии еще на 1,1 раза до 0,76±0,1 (t-Student= 3,09908; р<0,01).
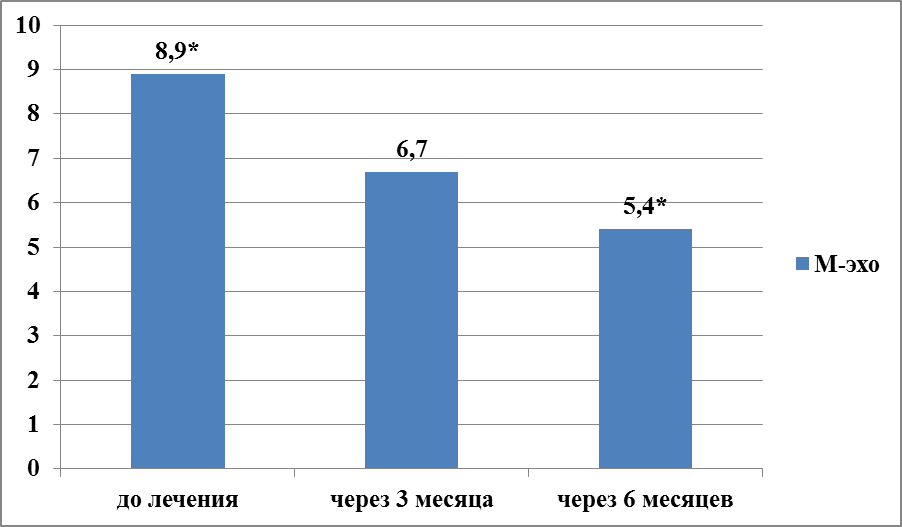
Рисунок 8 – Динамика показателя М-эхо у женщин с ГПЭ через 3 и 6 месяцев терапии микронизированным прогестероном (2-группа, N=35), мм, р*<0,01.
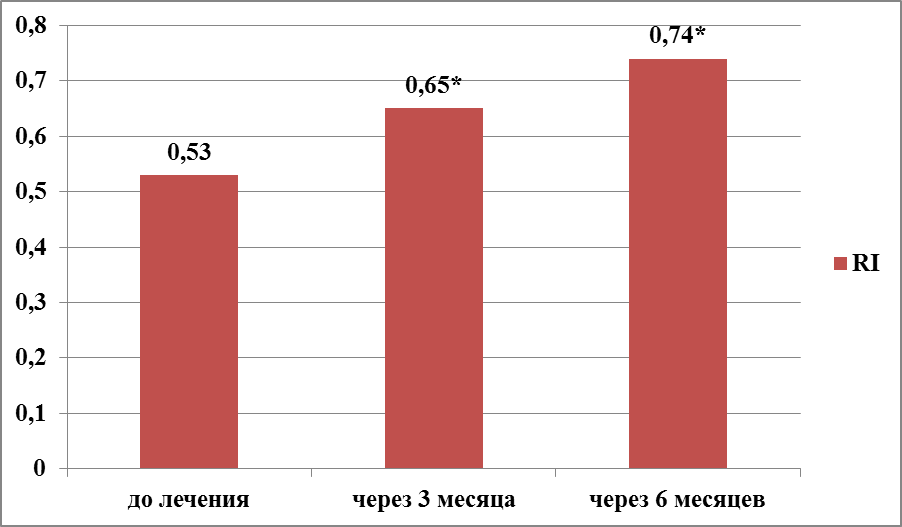
Рисунок 9 – Динамика показателя RI у женщин с ГПЭ через 3 и 6 месяцев терапии микронизированным прогестероном (2-группа, N=35), р*<0,01.
На рисунках 10, 11 и 12 представлена динамика корреляционных изменений показателя М-эхо и RI в 1а-группе, пациенток получавших лечение КОК с биоидентичным эстрогеном.
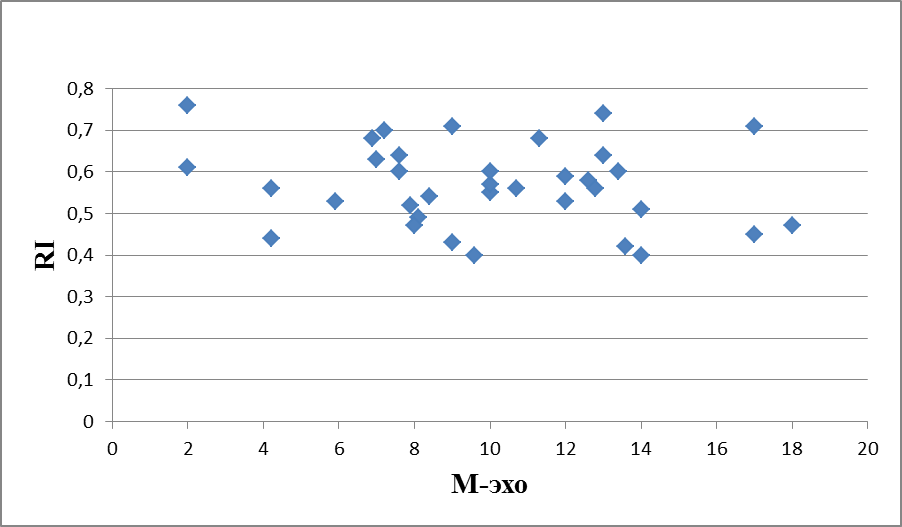
Рисунок 10 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ до начала терапии КОК с биоидентичным эстрогеном (1-группа, мм, N=35), индекс Пирсона -0,198099904.
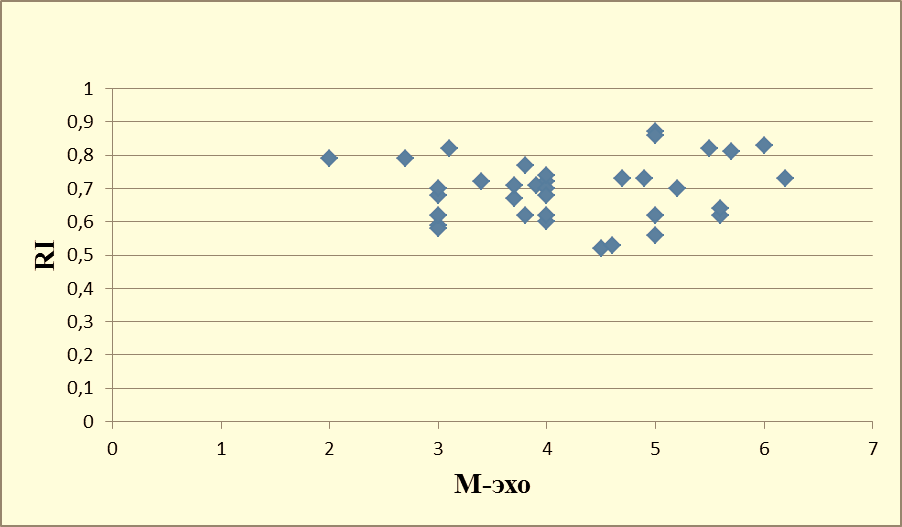
Рисунок 11 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 3 месяца терапии КОК с биоидентичным эстрогеном (1-группа, мм, N=35), индекс Пирсона 0,114500036.
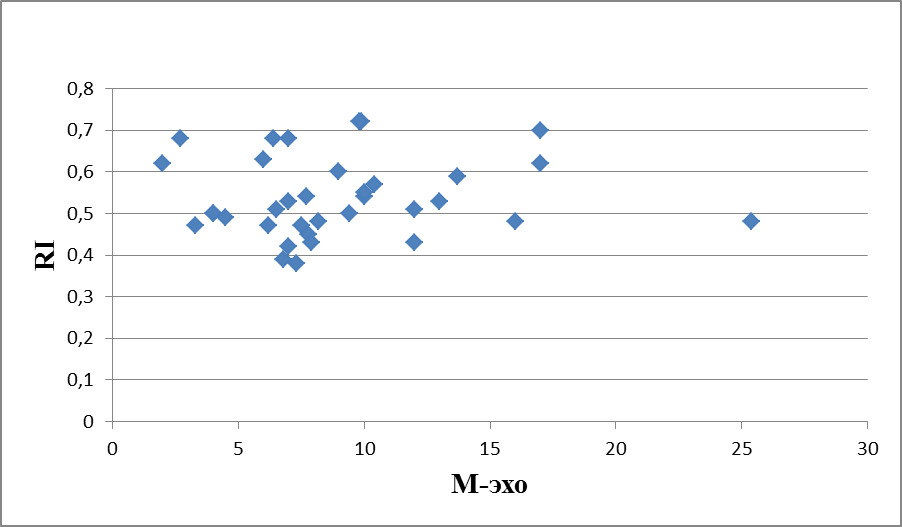
Рисунок 12 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 6 месяцев терапии КОК с биоидентичным эстрогеном (1-группы, мм, N=35), индекс Пирсона 0,045802109.
До начала лечения корреляционная связь между показателями была низкой – это иллюстрирует выраженный разброс значений (рисунок 10), а индекс Пирсона -0,198099904 указывал на отрицательную зависимость, то есть для высоких значений показателя М-эхо характерны низкие значения
RI. Через 3 месяца гормональной терапии индекс Пирсона составлял 0,114500036, через 6 месяцев 0,045802109 (рисунок 11), что указывало на положительную корреляционную связь с высокой плотностью значений. Данный факт можно трактовать как достижение определённого баланса между пролиферативной активностью эпителиоцитов и развитием сосудистой сети эндометрия.
На рисунках 13, 14, 15 представлена динамика корреляционных изменений показателя М-эхо и RI в 1-группе, пациенток получавших лечение микронизированным прогестероном. Корреляционная зависимость показателей М-эхо и RI в 2-группе женщин, получавших лечение менялась несколько иначе, чем в 1-группе. До лечения индекс Пирсона 0,053544147 показывал положительную корреляционную связь, при большом разбросе значений высоких показателей М-эхо и низких показателей RI (рисунок 13). Скорее всего, это связано с наличием случайной ошибки при статистическом распределении данных. Через 3 месяца терапии индекс Пирсона -165377218 указывал на отрицательную корреляцию показателей М-эхо и RI, при высокой частоте разброса значений (рисунок 14). Через 6 месяцев, на фоне лечения микронизированным прогестероном, индекс Пирсона 0,241173247 характеризовал тесную положительную корреляционную связь между показателями М-эхо и RI (рисунок 15), что также свидетельствовует о стабилизации клеточных изменений в эндометрии и пропорционально протекающих процессах пролиферации и васкуляризации.
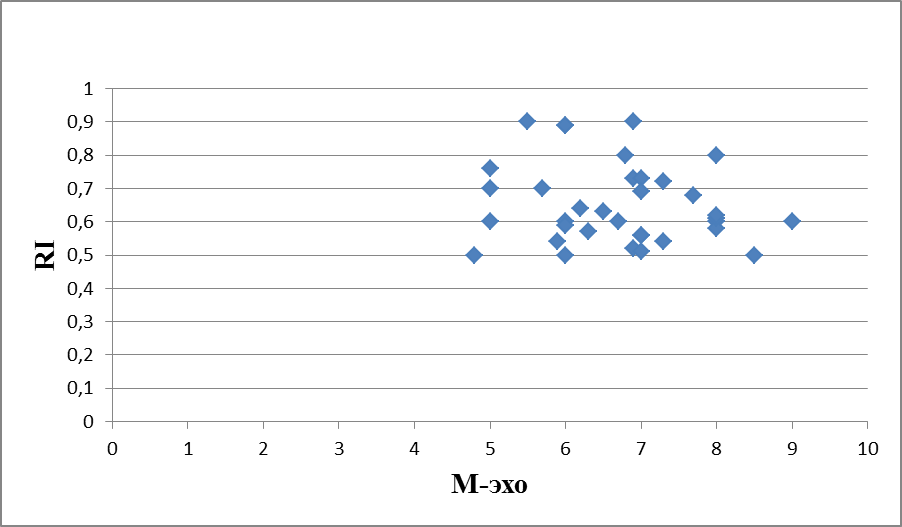
Рисунок 13 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ до начала терапии микронизированным прогестероном (2-группа, мм, N=35), индекс Пирсона 0,053544147.

Рисунок 14 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 3 месяца микронизированным прогестероном (2-группа, мм, N=35), индекс Пирсона -0,165377218.
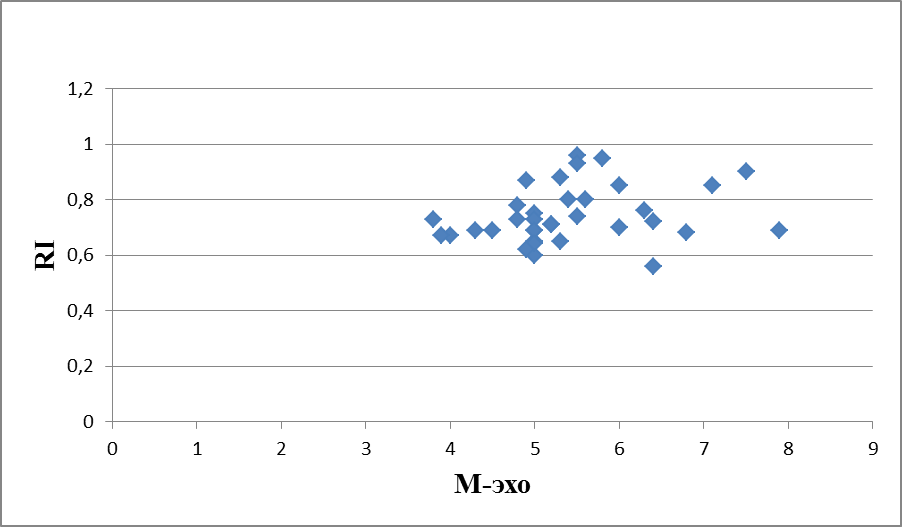
Рисунок 15 – Корреляционная зависимость показателей М-эхо и RI у женщин с ГПЭ через 6 месяцев терапии микронизированным прогестероном (2-группы, мм, N=35), индекс Пирсона 0,241173247.
Таким образом, результаты исследованных вариантов лечения гиперплазии эндометрия препаратами микронизированного прогестерона, так КОК с биоидентичным эстрогеном оказались сравнимы в отношении динамики УЗ картины, объективизированной измерением толщины эндометрия.
Эффективность терапии связана с достижением определённого баланса между пролиферативной активностью эпителиоцитов и развитием сосудистой сети эндометрия.
Заключение
Ультразвуковое исследование в гинекологии позволяет мониторировать результативность лечения гиперплазии эндометрия, выявляя достоверные различия в его толщине по действием терапии, будучи повторяемым и безопасным методом исследования. Гормональная терапия ГПЭ может быть проведена с одинаковой эффективностью как препаратами микронизированного прогестерона, так и КОК с биоидентичным эстрогеном. Продолжительость курса лечения для достижения оптимального эффекта должна составлять не менее 6 циклов.
Список использованной литературы
1. Fraser I.S., Langham S., Uhl-Hochgraeber K. Health-related quality of life and economic burden of abnormal uterine bleeding// Expert Rev. Obstet. Gynecol. – 2009.-Vol.4(2): 179-189.
2. The ESHRE Capri Workshop Group/ Human Reproduction Update, Vol.13, No.5 pp. 421–431, 2007 Advance Access publication March 2, 2007.
3. Обоскалова Т.А., Глухов Е.Ю., Нефф Е.И. Оказание медицинской помощи женщинам с гиперпластическими процессами эндометрия // Пособие для врачей. Екатеринбург, 2008 г.
4. Iram S., Musonda P., Ewies A.A. Premenopausal bleeding: When should the endometrium be investigated?—A retrospective non-comparative study of 3006 women. Eur. J. Obstet. Gynecol. Reprod. Biol. 2010; 148: 86–9.
5. Чернуха Г.Е., Немова Ю.И. «Диагностика и медикаментозная терапия маточных кровотечений с позиций международных рекомендаций»// Акушерство и гинекология, №2, 2013 г.
6. Munro MG, Critchley H, Fraser IS. Research and clinical management for women with abnormal uterine bleeding in the reproductive years: More than PALM‐COEIN. BJOG. 2017.
7. Management of Endometrial Hyperplasia. Green-top Guideline No. 67 RCOG/BSGE Joint Guideline | February 2016. Royal College of Obstetricians and Gynaecologists.
8. Буланов М.Н. Ультразвуковая гинекология: курс лекций в двух частях – М., 2017. Т.2.
9. Quantitative contrast-enhanced ultrasonography for the differential diagnosis of endometrial hyperplasia and endometrial neoplasms. Oncology Letters. Vol. 12 Issue 5 | November 2016.
