УДК 616.1
Лосева М.В.1, Исакова А.П.1 , Вишнева Е.М.1,2
«Современные представления о роли уровня липопротеина (а) в развитии сердечно-сосудистых заболеваний»
Кафедра факультетской терапии, профессиональных болезней
1Уральский государственный медицинский университет
2Многопрофильный медицинский центр ООО «Семейная клиника»
Loseva M.V.1, Isakova A.P.1, Vishneva E.M. 1,2
« ASSESSMENT OF THE ROLE OF LIPOPROTEIN A LEVEL IN THE DEVELOPMENT OF CARDIOVASCULAR DISEASES »
1Department of Faculty Therapy, Occupational Diseases
Ural state medical university
2 LLC “Family Clinic”
E-mail: loseva1998@inbox.ru
Аннотация. Проведено сравнительное исследование 2 групп пациентов с сердечно-сосудистыми заболеваниями с высоким и нормальным уровнями липопротеина(а) с целью определения связи между высоким уровнем Лп(а) и характером развития сердечно-сосудистых событий. По результатам исследования были сделаны выводы о значимости уровня Лп(а), а также гиполипидемической терапии у пациентов с сердечно-сосудистой патологией. Выявлены особенности популяции пациентов с ожидаемым повышением Лп(а) и преобладание поражения артерий брахиоцефального русла у лиц с повышенным Лп(а). Гиполипидемическая терапия статинами с удовлетворительной коррекцией липидного спектра не всегда позволяет осуществить контроль за увеличением Лп(а).Annotation. A comparative study of 2 groups of patients with cardiovascular diseases with high and normal levels of lipoprotein (a) was conducted to determine the relationship between high levels of Lp (a) and the nature of the development of cardiovascular events. According to the results of the study, conclusions were drawn about the significance of the level of Lp (a), as well as lipid-lowering therapy in patients with cardiovascular disease. The features of the patient population with the expected increase in Lp (a) and the predominance of damage to the arteries of the brachiocephalus in individuals with elevated Lp (a) were revealed. Hypolipidemic statin therapy with satisfactory correction of the lipid spectrum does not always allow monitoring of the increase in Lp (a).
Ключевые слова: липопротеин А, сердечно-сосудистая патология, мозговой инсульт, атеросклероз, липидный спектр, гиполипидемическая терапия.
Key words: lipoprotein A, cardiovascular disease, cerebral stroke, atherosclerosis, lipid spectrum, lipid-lowering therapy.
Введение. Актуальность дальнейшего поиска методов лечение сердечно-сосудистых заболеваний (ССЗ) обусловлена их преобладанием в структуре смертности во всем мире. Основной причиной сердечно-сосудистых катастроф является атеросклеротическое поражение артерий, в связи с этим основные лечебные мероприятия направлены на снижение уровня липопротеидов низкой плотности. Препаратами первой линии гиполипидемической терапии являются ингибиторы ГМГ-Коа редуктазы.
Однако в ряде ситуаций, несмотря на оптимальный контроль уровня ЛПНП, сохраняется высокий риск сердечно-сосудистых осложнений – 60-80% [2]. Причиной этого может являться высокий уровень липопротеина(а) (Лп (а)). Исследования продемонстрировали, что количественный уровень липопротеина(а) и особенно его низкомолекулярные фенотипы апо(а) являются независимыми факторами риска атеросклероза периферических, магистральных артерий и коронарного атеросклероза [1,4].
Лп(a) состоит из двух основных компонентов: ЛПНП-подобной частицы, содержащей апоВ-100, и специфической гликопротеиновой апо(а) частицы, подобной плазминогену, которые связаны между собой дисульфидным мостиком [5]. Уровень Лп(а) в плазме генетически детерминирован и обусловлен вариабельностью гена апо(а). Генотип Апо(а) определяет скорость синтеза, размер частицы апо(а) в Лп(а) и концентрацию Лп(а) в плазме [3]. Несмотря на вариабельность показателей у разных лиц, уровни Лп(а) у одного и того же лица считаются в целом постоянными с течением времени и заданы генетически, они не подвержены значительному влиянию диеты или факторов окружающей среды, опосредующих риск заболеваний сердечно-сосудистой системы на протяжении всей жизни пациента.
Липопротеин(а) фиксируется к бляшкам и задерживается в артериальной стенке; улучшает образование пенистых клеток, генерирует окисленные радикалы в моноцитах, способствует пролиферации клеток гладких мышц и индуцирует моноцит-хемотаксическую активность в субэндотелиальных пространствах [6]. Кроме того, липопротеин(а) может стимулировать образование тромбов вследствие ингибирования фибринолиза.
Показатели концентрации Лп(а) в крови более 50 мг/дл составляют до 20% от общей численности населения и еще с большей частотой встречаются у пациентов с ССЗ и аортальным стенозом. Уровень Лп(а) больше 30 мг/ дл выявляется у 37–40% больных с высоким риском развития ССО и только у 14% лиц низкого риска. При хронической ишемической болезни сердца (ИБС) частота высокого уровня Лп(а) среди мужчин достигает 39%, среди женщин – 48%, тогда как у больных без ИБС – 12–15% [9].
Согласно данным исследования JUPITER («Обоснование использования статинов в профилактике: исследование интервенционной оценки розувастатина»), статины обладают небольшим эффектом, повышающим уровень Lp (a), а не снижающим эффект [7]. Кроме того, различные стратегии снижения уровня липидов, в том числе статины в сочетании с эзетимибом и / или ниацином, приводят к увеличению уровня Lp (a) на 11% при сопутствующем увеличении OxPL-apoB на 24% [8].
Объединенный анализ 4 исследований II фазы, в которых изучался эволокумаб (AMG 145) у 1359 пациентов, показал дозозависимое снижение уровня Лп(a) по сравнению с плацебо. Снижение уровней Лп(a) было связано со снижением ЛПНП и аполипопротеина B, тогда как абсолютное снижение было выше у пациентов с уровнями Лп(а) > 50 мг/дл [10].
Цель исследования – оценить влияние Лп(а) в развитии тяжелых сердечно-сосудистых заболеваний, а также оценить возможности медикаментозной терапии высокого уровня Лп(а).
Материалы и методы исследования
Дизайн исследования: одномоментное поперечное исследование пациентов с манифестными ССЗ, получающих полноценную комбинированную терапию ССЗ в течение ближайших 6 месяцев. Все пациенты гиполипидемическую терапию статинами, достигали целевых значений АД, антиагреганты, иАПФ, В-адреноблокаторы.
Критерии включения: пациенты мужского и женского пола в возрасте от ≥18 до ≤80 лет, наличие манифестного заболевания сердечно-сосудистой системы, определяемое как одно из следующего: наличие в анамнезе инфаркта миокарда в период от ≥ 3 месяцев до ≤ 10 лет, наличие в анамнезе ишемического инсульта в период от ≥ 3 месяцев до ≤ 10 лет, симптоматическое заболевание периферических артерий.
Выполнялся сбор анамнеза, клинико-демографических данных, проводились антропометрическое измерение и исследование липидного спектра плазмы крови. Антропометрическое исследование включало определение роста (м), массы тела (кг), ИМТ по формуле Кетле. Критериями избыточной МТ считалось ИМТ 25-30 кг/м2, ожирения – ИМТ ≥ 30 кг/м2. Лабораторное исследование включало определение уровня ОХС, ТГ, ЛПВП, ЛПНП, Лп (а) плазмы крови. Статистическая обработка результатов проводилась с использованием компьютерной программы «STATICTICA 10.0». Для парных сравнений использованы методы сравнительной статистики (U-критерий Манна-Уитни, Т-критерий Уилкоксона). Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
В исследование было включено 52 пациента (25 мужчин и 27 женщин), средний возраст 67,25±7,8 лет, с манифестными ССЗ, получавших лечение кардиолога в ООО «Семейная клиника» в течение 1 месяца. Возрастная и гендерная структура выборки соответствует естественной структуре и коррекции не подвергалась. Нормальная масса тела у 2 пациентов (3,8%), избыточная масса тела у 24 пациентов (46,2%), ожирение 1 степени у 12 пациентов (23,1%), ожирение 2 степени у 10 пациентов (19,2%), ожирение 3 степени у 4 пациентов (7,7%). АГ страдали 48 пациентов (92,3%), стенокардия напряжения у 35 пациентов (67,3%), ИМ в анамнезе у 26 пациентов (50%), ишемический инсульт (ИИ) в анамнезе у 25 пациентов (48,1%), облитерирующий атеросклероз артерий нижних конечностей (ОА Н/К) у 21 пациента (40,4%), атеросклероз брахиоцефальных артерий (А БЦА) у 35 пациентов (67,3%), сахарный диабет 2 типа (СД 2) у 22 пациентов (42,3%).
Исследуемая выборка по результатам лабораторных данных была разделена на 2 группы на основании уровня Лп(а).
I группа включала 13 (25%) пациентов, у которых уровень Лп(а) ≥0,3 г/л: 3 мужчин и 10 женщин, возраст 70,3±7,6. При анализе нозологической структуры сердечно-сосудистых заболеваний выявлено, что в данной группе АГ страдали 13 (100%) пациентов, стенокардия напряжения выявлена у 9 (69,2%) пациентов, ИМ в анамнезе был у 4 (30,8%) пациентов, ИИ в анамнезе был у 9 (69,2%) пациентов, ОА Н/К выявлен у 3 (23,1%) пациентов, А БЦА – у 12 (92,3%) пациентов, СД 2 страдали 5 (38,5%) пациентов. Уровень ОХС в данной группе составляет 4,25 [4,18; 6,31] ммоль/л, уровень ТГ – 1,84 [1,13; 2,3] ммоль/л, уровень ЛПВП – 1,4 [1,25; 1,61] ммоль/л, уровень ЛПНП - 2,52 [2,07; 4,29] ммоль/л, уровень Лп(а) – 0,72 [0,44; 1,21] ммоль/л.
II группа включала 39 (75%) пациентов, у которых уровень Лп(а) <0,3 г/л: 22 мужчин и 17 женщин, возраст 66,23±7,7. При анализе нозологической структуры сердечно-сосудистых заболеваний выявлено, что в данной группе АГстрадали 35 (89,7%) пациентов, стенокардия напряжения выявлена у 26 (66,7%) пациентов, ИМ в анамнезе был у 22 (56,4%) пациентов, ИИ в анамнезе был у 16 (41%) пациентов, ОА Н/К выявлен у 18 (46,2%) пациентов, А БЦА – у 23 (59%) пациентов, СД 2 страдали 17 (43,6%) пациентов. Уровень ОХС в данной группе составляет 4,35 [3,65; 5,35] ммоль/л, уровень ТГ – 1,63 [1,25; 2,66] ммоль/л, уровень ЛПВП – 1,11 [0,91; 1,33] ммоль/л, уровень ЛПНП - 2,46 [1,75; 3,15] ммоль/л, уровень Лп(а) – 0,08 [0.,4; 0,12] ммоль/л.
Таблица 1.
Характеристика исследуемых групп
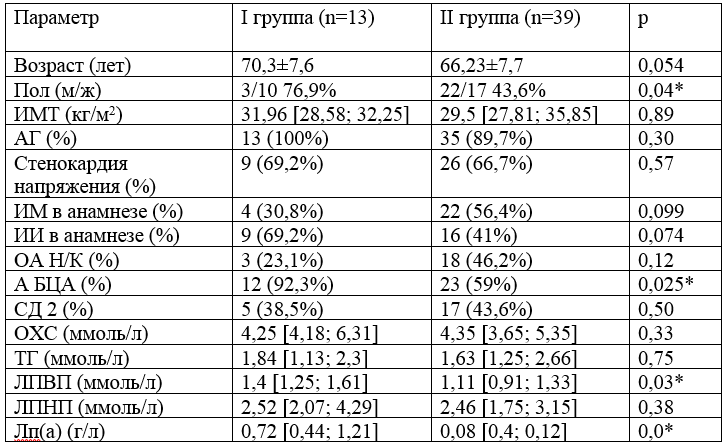
Рис.1
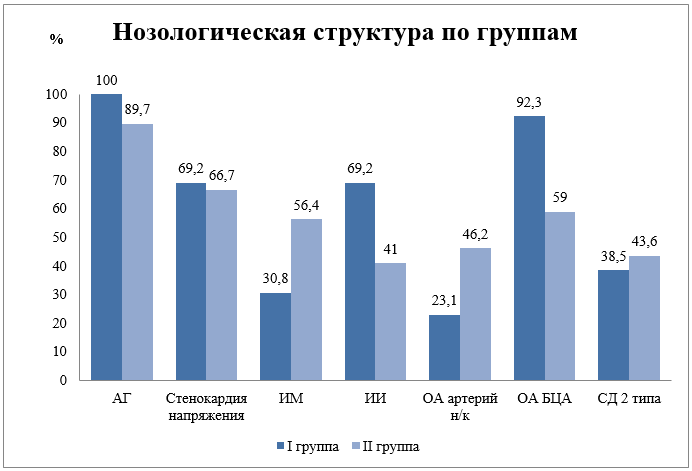
В таблице 1 представлена характеристика двух исследуемых групп. Анализ полученных данных показал, что в группе I с повышенным уровнем Лп(а) почти в 1,56 раз чаще выявлялось атеросклеротическое поражение артерий брахиоцефального русла, что является статистически значимым различием (p<0,025). Выявлена достоверная положительная слабая связь атеросклероза БЦА и уровня Лп(а) (r =0,20, p < 0,025).
Стоит отметить, что количество ишемическим инсультов в I группе превышало группу II в 1,68 раз, данное различие оказалось статистически не значимым, однако размер выборки был невелик.
При сравнении исследуемых групп выявлена достоверная умеренная положительная связь женского пола и уровня Лп(а) (r = 0,49, p < 0,05), а также достоверная умеренная положительная связь возраста и уровня ЛПа (r =0,35, p < 0,054).
Выводы. Согласно статистическим данным исследования, уровень липопротеин(а) оказывает влияние на конкретные сердечно-сосудистые события: отмечается преобладание поражения артерий брахиоцефального русла у лиц с повышенным уровнем Лп(а).В данной выборке отмечается более высокая частота встречаемости повышенного уровня Лп(а) у лиц женского пола и старшей возрастной группы, что доказано достоверно умеренными положительными корреляционными связями, что позволяет повысить настороженность к пациентам с такими характеристиками для дополнительного лабораторного скрининга в отношении Лп(а). При удовлетворительной коррекции липидного профиля не всегда приходится рассчитывать на снижение уровня Лп(а) при терапии статинами, что ставит новые задачи перед медициной по разработке препаратов и возможности контроля за уровнем Лп(а).
Список литературы
1. Зуева И.Б., Бараташвили Г.Г., Кривоносов Д.С., Буч А.В., Сидоркевич С.В. Липопротеин (А) как фактор сердечно-сосудистого риска. Современное состояние проблемы. Вестник российской военно-медицинской академии. 2017; 1(57): 219-225.
2. Зуева И.Б., Бараташвили Г.Г., Кривоносов Д.С., Буч А.В., Сидоркевич С.В. Современные представления о роли липопротеина (а) в развитии сердечно-сосудистых событий. Возможности терапии. Артериальная гипертензия. 2016; 22(3): 232-242.
3. Пизов Н.А., Пизова Н.В. Роль липопротеина (а) в развитии ишемического инсульта и других сердечно-сосудистых заболеваний. Неврология, нейропсихиатрия, психосоматика. 2016;(8)1:90–95.
4. Тмоян Н.А., Ежов М.В., Афанасьева О.И., Клесарева Е.А., Разова О.А., Кухарчук В.В., Покровский С.Н. Связь липопротеида А и фенотипов апобелка А со стенозирующим атеросклерозом периферических артерий. Терапевтический архив. 2018; 90(9):31-36.
5. Schmidt K. et al. Structure, function, and genetics of lipoprotein (a) //Journal of lipid research. – 2016. – Т. 57. – №. 8. – С. 1339-1359.
6. van der Valk F. M. et al. Oxidized phospholipids on lipoprotein (a) elicit arterial wall inflammation and an inflammatory monocyte response in humans //Circulation. – 2016. – Т. 134. – №. 8. – С. 611-624.
7. Khera A. V. et al. Lipoprotein (a) concentrations, rosuvastatin therapy, and residual vascular risk: an analysis from the JUPITER Trial (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin) //Circulation. – 2014. – Т. 129. – №. 6. – С. 635-642.
8. Yeang C. et al. Effect of therapeutic interventions on oxidized phospholipids on apolipoprotein B100 and lipoprotein (a) //Journal of clinical lipidology. – 2016. – Т. 10. – №. 3. – С. 594-603.
9. Graham, M.J. Antisense inhibition of apolipoprotein (a) to lower plasma lipoprotein (a) levels in humans / M. J. Graham [et al.] // J Lipid Res. – 2016. – Vol. 57(3). – P. 340–351.
10.Raal F. J. et al. Reduction in lipoprotein (a) with PCSK9 monoclonal antibody evolocumab (AMG 145): a pooled analysis of more than 1,300 patients in 4 phase II trials //Journal of the American College of Cardiology. – 2014. – Т. 63. – №. 13. – С. 1278-1288.
